微生物の量はどのように調べるか
微生物(細菌・酵母・カビ)に関するさまざまな試験をするなかで、微生物が増殖した量や減少した量を調べることがよくあります。微生物の量を測定する方法には、微生物の細胞の数を数える直接的な方法と、細胞の存在に起因するさまざまな指標を定量的に検出する間接的な方法があります。
直接的な検出方法と間接的な検出方法
(1) 直接的な検出方法の例
a) 菌数計算盤による計測
格子が刻まれた菌数計算盤(血球計算盤など)に微生物の量を測定したい液体(検体)を添加し、顕微鏡で見て、ある区画内の細胞の数を直接数える方法です。数えた値を、検体1 mLあたりに換算し、菌数を算出します。原理が単純で迅速な方法ですが、①生菌と死菌を区別できない、②細胞と同程度の大きさの他のものと見分けが必要、③菌数の少ない検体には適さない、などのデメリットがあります。
b) 寒天平板で培養してコロニーを数える方法
弊社でもっともよく行う方法です。後の項で詳しく解説します。
(2) 間接的な検出方法の例
a) 濁度測定
液中に存在する微生物によって生じる濁りを菌数の指標にします。分光光度計を用いて、検体に光を透過させ、透過光の量を測定し、濁度を求めます。試験菌液の生菌数を見積もる際によく用いられます。
b) 重量による測定
菌体の重量を測定し、微生物の量を見積もる方法です。JIS Z 2911の試験法の中には、重量による評価を行う方法もございます(弊社では受託しておりません)。
c) 細胞成分や生化学的活性を測定する方法
細胞構成成分の量を測定し、微生物の量を見積もる方法です。ATP量の測定がその一例です。JIS L 1921などで用いられます。
微生物(細菌・酵母・カビ)の試験では培養してコロニーを数える方法がよく用いられる
保存効力試験や各種の抗菌試験など、菌に対しての影響(増殖抑制、殺菌など)を定量的に評価するときには、検体を培養してコロニーを数え、生菌数を測定する方法がよく用いられます。検体の中には、例えば106個(100万個)や108個(1億個)といったレベルの微生物が含まれているものもありますが、後述のように、検体を希釈することで生菌数を測定することができます。
●培養による生菌数測定の手順
検体に多くの微生物が含まれることが予想できたとき、あるいは、どの程度の微生物が含まれるのか全く見当がつかないときには、検体を適当な溶液(生理食塩水、精製水、リン酸緩衝生理食塩水、SCDLP液体培地※など)で10倍、100倍、…と、段階的に希釈していきます。このように希釈していった液をまとめて、10倍希釈系列とよびます。
※検体に高い抗菌効果があることが予想されるような場合は、抗菌成分を中和するような成分の入った溶液が適切です。
希釈したそれぞれの液を、試験目的や菌の特性を考慮して選択した寒天培地(9 cm程度のシャーレ内で扱うことが多い)に接種します。接種の方法は主に2つあります。
(1) 塗抹法
0.1 mLまたは適当な量の液を、冷えて固まった寒天培地の表面にコンラージ棒などを用いて塗抹する方法です。
(2) 混釈法
1 mLの液を、溶解した寒天培地に混合してシャーレ内に流し、冷まして固める方法です。弊社では、混釈用の自動機器を導入し、効率化・精度向上を図っています。溶解した寒天の温度が高いと実際の数より少なく計測されてしまうため、寒天の温度が45℃前後になるよう注意が必要です。
液を接種した寒天培地を適切な条件で培養すると、生きている細菌は分裂・増殖して、それぞれ数億個レベルの菌の塊(コロニー、集落)を作り、肉眼でも見えるようになります(混釈法の場合は、培地内部にもコロニーが形成されます)。各希釈倍率の液を接種した寒天培地シャーレの中から、数十~数百個(細菌の場合)のコロニーが形成されているシャーレを選べば、コロニーを数えることができます。
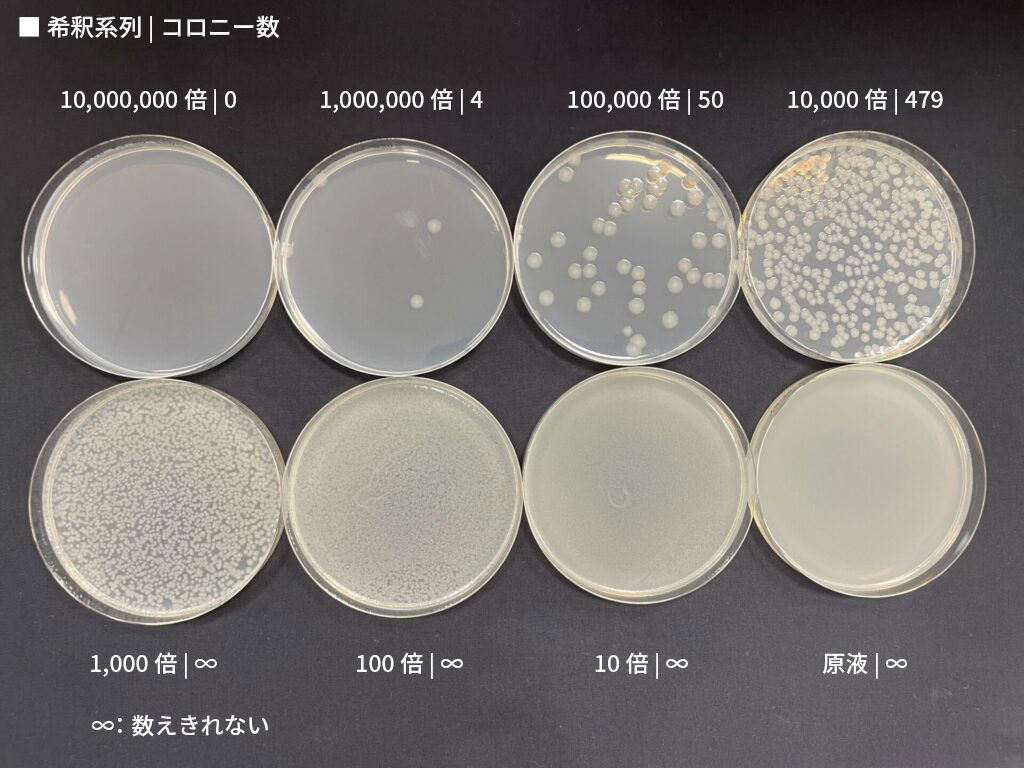
生きている細菌1個から1つのコロニーが形成されると考えれば、数えたコロニー数・接種した液量・希釈倍率から、検体の単位体積(1 mLなど)あたりの生菌数を求めることができます。
ただし、カウントしたコロニーは、必ずしも1個の菌から形成されたとは限りません。凝集して接着したままの菌同士が1つのコロニーを形成することもありえます。そこで、この方法で算出された生菌数の単位として、CFU(colony forming unit、コロニー形成単位)を用います。1 mLあたりの生菌数であれば、CFU/mLという単位を用いて表すことができます。
【生菌数の計算例】*こちらにも記載があります。
1. 検体を10,000倍希釈して0.1 mL接種し、培養したシャーレに形成されたコロニーを数えると257個であった場合。
→257×10,000=2.57×106[CFU/0.1 mL]なので、1 mLあたりでは10倍して、2.57×107[CFU/mL]
2. 検体を100倍希釈して1 mL接種し、培養した培養したシャーレに形成されたコロニーを数えると91個であった場合。
→91×100=9.1×103[CFU/mL]
●検出限度を上げる方法(メンブレンフィルター法)
塗抹法や混釈法では、0.1 mLや1 mLなどの液を寒天培地に接種します。0.1 mL接種した場合、検体1 mLあたりの生菌数が10個未満であれば、理論上菌が検出できません。1 mL接種した場合は、検体1 mLあたり1個未満で検出不可となります。後者の場合、多少検出限度が上がりますが、それでも生菌数が非常に少ない場合は菌が検出できません。
高い検出限度が要求される場合は、メンブレンフィルター法という方法があります。この方法では、まず、メンブレンフィルター(検体を通すが、細菌は通り抜けられないような孔が開いているフィルター)を用いて検体全量または一定量をろ過します。次に、このメンブレンフィルターを寒天培地にのせ、適切な条件で培養します。寒天培地の成分がメンブレンフィルターに浸み出しますので、培養すると、メンブレンフィルター上にあった細菌がコロニーを形成します。このコロニーを数えることで、検体中の生菌数を調べることができます。
【例】
・検体全量をろ過したメンブレンフィルターを培地上にのせて培養し、フィルター上に形成されたコロニーを数えると30個であった場合。
→検体全量あたり30 CFU
●培養して生菌数を調べる方法のデメリット
培養して生菌数を測定する方法は広く用いられていますが、デメリットももちろんあります。①培養条件によって生菌数が異なる場合がある、②希釈に手間がかかり、慣れていないと誤差が生じることがある、③培養に時間を要する、などが主なデメリットです。
●塗抹法・混釈法・メンブレンフィルター法のまとめ
最後に、各方法のメリット・デメリット・検出限度をまとめました。試験目的、得たい精度などを考慮して方法を選択する必要があります。
| 方法 | メリット | デメリット | 検出限度例 |
| 塗抹法 | ・検体残渣とコロニーの区別が容易 ・コロニー性状の観察が可能 ・コロニーを釣菌して同定することが可能 | ・高い検出限度が設定しにくい ・塗抹する前に培地表面を乾燥させる必要がある | 10 CFU/mL |
| 混釈法 | ・塗抹法に比べ高い検出限度が設定できる | ・検体残渣が多いとカウントが難しい ・溶解した寒天による熱の影響を受けやすい ・コロニー性状が観察しにくい ・コロニーを釣菌して同定することが困難 | 1 CFU/mL |
| メンブレンフィルター法 | ・高い検出限度が設定できる ・抗菌成分の中和が容易 | ・操作が煩雑である ・コストが比較的高い ・高粘度のサンプル、残渣があるサンプルでは困難 | 1 CFU/検体全体 |
